- Большинство патогенных микроорганизмов выращивают
- Выращивание микроорганизмов
- Рост культур на различных средах
- Культуральные признаки основных видов микроорганизмов, влияющих на качество продуктов
- Исследовательская работа «Анализ условий питательной среды для бактерий»
- Скачать:
- Предварительный просмотр:
- Особенности подбора питательной среды для бактерий
- Выделение чистой культуры
- Культивирование колоний микроорганизмов: принципы
- Принципы культивирования молочнокислых бактерий
- Культивирование анаэробных представителей рода Энтерококков
- Условия выращивания (культивирования) микроорганизмов
Большинство патогенных микроорганизмов выращивают
Для успешного культивирования микроорганизмов важно не только правильно подобрать питательную среду и правильно произвести посев, но еще необходимо создать и оптимальные условия: обеспечить соответствующую температуру, влажность, аэрацию. Как правило, успешное культивирование микроорганизмов в лаборатории удается только при тщательном воспроизведении условий природной для них среды.
Оптимальную температуру при культивировании большинства патогенных для теплокровных (в том числе и человека) микроорганизмов (37 градусов) создают в термостате.
Термостат представляет собой прибор с двойными стенками, между которыми находится воздух или вода. Подогрев воды осуществляется при помощи электрического тока. Термостат снабжен терморегулятором, автоматически поддерживающим нужную температуру, и термометром для контроля за температурой.
Пробирки с посевами устанавливают в штативах на полках термостата. Чашки в термостате должны стоять вверх дном.
Чтобы воздух в термостате свободно циркулировал и нагрев был равномерным, полки в термостате делают с прорезами и при работе плотно не загружают.
Чтобы не охладить культуры, термостат надолго не оставляют открытым.
Жизнь микроорганизмов возможна только во влажных условиях. Для микробов необходима капельно – жидкая среда – вода, так как питательные вещества проникают в клетку только в растворенном состоянии. Минимальное содержание свободной воды, при котором еще возможно развитие, для большинства микроорганизмов равно примерно 20%.
При культивировании в жидких питательных средах проблемы поддержания влажности не существует.
Свежеприготовленные агаризированные среды всегда содержат некоторое количество капельно – жидкой воды. Она бывает заметна в виде более или менее обильного конденсата, Однако при длительном хранении культур на плотных средах при комнатной температуре и даже в холодильнике среды подсыхают, что может привести к гибели микроорганизмов. Поэтому необходимо производить регулярные своевременные пересевы культур, не допуская подсыхания сред. Если предполагается длительное культивирование в термостате, то чашки или пробирки лучше всего поместить во влажную камеру, т.е в закрытый сосуд, где имеется емкость с водой. Некоторые грибы могут расти на плотных субстратах без капельно – жидкой среды, но во влажной атмосфере.
В день посева плотные питательные среды, основу которых составляет агар – агар, расплавляют на водяной бане и в жидком состоянии стерильно разливают в чашки Петри. После застывания агара и подсушивания конденсационной воды в термостате, можно производить посев на пластинчатый агар. Скашивать плотные питательные среды в пробирках также лучше в день посева. При культивировании микробов особенно чувствительных к отсутствию влаги (например, гонококков) в термостат ставят открытый сосуд с водой.
Подавляющему большинству микробов, в том числе и патогенным, свет не нужен. Прямые солнечные лучи отрицательно влияют на развитие многих микроорганизмов, поэтому их культивируют в неосвещенных термостатах. Однако, для изучения пигментообразования, которое происходит активнее при рассеянном свете, культуры после термостата выдерживают 2 – 3 дня при комнатном освещении.
Микроорганизмы, использующие в процессах обмена веществ энергию света, выращиваются при освещении. Для освещения обычно применяют лампы накаливания мощностью 75 – 100 вт. При культивировании водорослей можно использовать и люминесцентные лампы.
Большинство патогенных микробов культивируют 18 – 24 часа, но есть виды, развивающиеся значительно быстрее (холерный вибрион 8 – 10 часов) или медленнее (бруцеллы 5 – 27 дней, туберкулезные бактерии 4 – 6 недель и т.д.).
Продолжительность культивирования микроорганизмов зависит от скорости их размножения. Чтобы сохранить влагу в пробирках при длительном культивировании микробов, ватные пробки после посева заменяют стерильными резиновыми или надевают на них резиновые колпачки.
По потребности микробов в свободном кислороде их делят на облигатные аэробы (возбудители холеры, чумы, туберкулеза), анаэробы (возбудители столбняка, ботулизма, газовой раневой инфекции, бактероиды) и факультативные анаэробы (возбудители брюшного тифа, дизентерии, стафилококки и др.). Эти группы требуют различных условий культивирования.
При культивировании аэробов и факультативных анаэробов поступление необходимого кислорода осуществляется при пассивной и активной аэрации.
Пассивная аэрация – это культивирование микроорганизмов на плотных и жидких питательных средах, закрытых ватными или ватно – марлевыми пробками, а также на плотных питательных средах в чашках Петри. В этом случае микроорганизмы развиваются на поверхности среды и получают кислород непосредственно из воздуха пробирки или чашки Петри. Поэтому при поверхностном культивировании микроорганизмов стараются увеличить площадь соприкосновения среды с воздухом. Для этого среды наливают тонким слоем в посуду с широким дном (чашки Петри, колбы Виноградского, матрацы).
На жидких средах аэробные микроорганизмы растут в виде пленок, обычно достаточно плотных. Факультативные анаэробы развиваются также и в толще жидкой среды, образуя более или менее равномерное помутнение или хлопья. Для них характерны менее плотные пленки, чем для облигатных аэробов.
Поверхностное культивирование микроорганизмов применяют в лабораториях и в промышленности.
Активную аэрацию применяют при глубинном культивировании микробов, когда их выращивают в больших объемах среды. Чтобы достаточно снабдить кислородом такие культуры, их помещают в специальные качалки – постоянное перемешивание культуры обеспечивает соприкосновение ее с воздухом. При культивировании микробов в объемах жидкости, достигающих десятков и сотен литров, используются приборы, называемые реакторами или ферменторами. Воздух продувают через культуру при помощи специальных устройств.
Культивирование анаэробов сложнее, чем аэробов, так как их необходимо лишить доступа свободного кислорода воздуха. Для этого из питательной среды удаляют воздух, применяя различные способы:
1. Удаление кислорода механическим путем. Анаэробные микроорганизмы можно культивировать в обычных чашках Петри, помещая их сразу после засева в анаэростат, из которого затем откачивается воздух. Анаэростаты – это вакуумные металлические или стеклянные эксикаторы. Металлические анаэростаты имеют герметически закрывающуюся крышку и снабжены манометром. Они способны сохранять высокое разряжение в течение длительного времени. Стеклянные вакуумные эксикаторы имеют пришлифованную крышку с краном на шлифах для откачивания воздуха. Пришлифованные поверхности эксикатора во избежание проникновения в него воздуха покрывают специальной вакуумной смазкой.
2. Замещение воздуха в анаэростате азотом, аргоном, водородом или смесью азота с углекислым газом.
3. Культивирование в высоком столбике агара с глюкозой. При этом способе микроорганизмы растут на дне, защищенные от воздуха высоким слоем среды.
4. Удаление кислорода химическим способом достигается при его окислении различных веществ кислородом, содержащимся в среде и сосудах для культивирования.
5. Метод Виньяля – Вейона заключается в том, что посев производят в пробирку с расплавленным и остуженным до 45 градусов агаром. Содержимое пробирки перемешивают и набирают в пастеровскую пипетку при помощи груши, заполняя пипетку до самого верха. Необходимо следить, чтобы в пипетку не попали пузырьки воздуха. Тонкий конец пипетки запаивают и пипетку помещают в термостат. В толще агара вырастают изолированные колонии анаэробов.
6. Добавление в среду редуцирующих (окисляющих) веществ. Используют среду Китт – Тароцци, содержащую в качестве редуцирующих веществ 0,5% раствор глюкозы, кусочки печени или яичного белка. Перед посевом среду кипятят 20 минут на водяной бане для удаления из нее растворенного кислорода. Перед посевом в пробирку на поверхность питательной среды наливают стерильное масло слоем 0,5 – 1,0 см для защиты анаэробов от проникновения кислорода.
7. Биологический метод Фортнера. В чашку Петри наливают толстым слоем агар с 5% крови. Чтобы культуры не смешивались, по диаметру чашки делают желобок в агаре. На одну половину питательной среды засевают аэробы, на другую – анаэробы. Края чашки тщательно заливают парафином. Посевы ставят в термостат. Сначала вырастают аэробы, а после поглощения ими кислорода, находящегося в чашке, начнут развиваться анаэробы.
Культивирование актиномицетов, грибов, микоплазм, L-форм, спирохет и простейших принципиально сходно с культивированием бактерий. Для них разработаны специальные среды и подобраны режимы, соответствующие их потребностям.
По типу питания грибы являются гетеротрофами. В качестве источника углерода грибы могут использовать большинство органических веществ. Однако, некоторые грибы лучше используют глюкозу, другие – фруктозу или пентозу. В качестве источника азота грибы могут использовать такие органические соединения как белки, пептон, пептиды, аминокислоты, соли аммония, нитраты, азот атмосферы. Диапазон использования перечисленных источников азота у разных видов грибов неодинаков.
Для роста и жизнедеятельности грибов необходимы минеральные вещества. Кроме макроэлементов (углерода, кислорода, водорода, азота, серы, фосфора, калия, кальция, магния, железа) им необходимы и микроэлементы (марганец, цинк, медь, кобальт, никель и др.).
Важную роль в физиологии грибов играют витамины. Потребность в витаминах у грибов зависит от ростовой реакции.
В отношении питательных сред большинство грибов крайне непритязательны. Они хорошо растут на самых разнообразных субстратах: картофеле, моркови, сахарном агаре, глицериновом агаре. Оптимальный рост грибов происходит при температуре 26 – 28 градусов. В зависимости от состава питательной среды особенности культуральных чвойств того или иного гриба могут варьировать.
Грибы культивируют с разными целями – для поддержания в жизнеспособном состоянии без потери функций и особенностей строения, для идентификации, получения продуктов метаболизма грибов, сохранения посевных культур и т.д. Подбор среды для культивирования грибов зависит от цели исследования и биологических особенностей микроорганизма.
Среды для культивирования грибов по составу ингредиентов бывают: 1. Природные – разнообразные субстраты растительного и животного происхождения (корнеплоды, зерно злаков, листья, стебли растений, органы и ткани животных).
2. Полусинтетические – это комбинированные среды из природных субстратов и химически известных компонентов.
3. Синтетические – состоящие из ингредиентов известного состава. Различные комбинации ингредиентов в синтетических средах и их концентраций практически не ограничены и могут служить для выяснения разнообразных процессов жизнедеятельности грибов, связанных с их ростом, размножением и физиологической активностью.
Для актиномицетов наиболее подходящими питательными средами являются щелочной глицериновый агар, картофель, сывороточные, мясные и асцитические среды, а также агар Сабуро. Посевы культивируют в аэробных и анаэробных условиях при 35 – 37 градусах не менее двух недель.
Культивирование кишечных простейших на специальных питательных средах является биологическим методом обогащения, позволяющим из единичных экземпляров паразитов получить достаточное их количество. Увеличение количества экземпляров в результате их размножения на питательной среде облегчает обнаружение и изучение паразитов.
Для культивирования кишечных амеб применяется среда, в состав которой входят четыре яйца и среда Локка (1000 мл дистиллированной воды, NaHCOз – 0,2г, хлористый кальций – 0,2г, KCl – 0,4г, NaCl – 9,0г, глюкозы – 2,5г, рН среды – 7,4). Для получения скошенной поверхности среды, пробирки в наклонном положении помещают в аппарат для свертывания и выдерживают при 70 градусах до затвердевания. Перед посевом в пробирку с плотной питательной средой добавляется несколько капель инактивированной человеческой или лошадиной сыворотки и 1 – 2 петли стерильного рисового отвара.
Для культивирования жгутиконосцев к 200 мл среды Локка добавляется одно яйцо, и полученная смесь подогревается на водяной бане в течение 15 минут. Затем смесь фильтруется через марлю, разливается по 5 – 6 мл в пробирки и стерилизуется в автоклаве под давлением в течение 20 минут.
При культивировании балантидий может быть использована среда Френкеля (4,0г аспарагина, 6,0г ammonium lacticum, 2,0г двухзамещенного фосфорнокислого калия, 5,0г NaCl, 1000 мл дистиллированной воды). Среда стерилизуется в автоклаве в течение 20 минут при 120 градусах, 1 атм. Затем к ней добавляются стерильные лошадиная сыворотка в разведении 1:10 и 2 – 3 капли крахмала (рН среды 7,2 – 7,4).
Культивирование простейших осуществляется в термостате при 37 градусах. Пересевы проводятся через день.
Риккетсии, хламидии и вирусы, являющиеся строгими внутриклеточными паразитами, совершенно не культивируются на искусственных питательных средах, используемых для культивирования бактерий, грибов, микоплазм и простейших.
Риккетсии обладают собственным метаболизмом, однако являются полностью энергетически зависимыми от тканевой клетки, поэтому риккетсии и являются внутриклеточными паразитами.. В клетке хозяина каждый вид риккетсий размножается только в определенных местах: в цитоплазме, ядре или вакуолях клеток. Риккетсии культивируются в кишечнике платяных вшей, желточном мешке развивающегося куриного эмбриона, в клетках легких белых мышей, в клетках неперевиваемых культур тканей.
У хламидий наблюдается не только энергетическая зависимость от клетки ткани, но и слабо выражена метаболическая активность. Поэтому хламидии можно культивировать только в желточном мешке развивающегося куриного эмбриона или в клетках культур тканей.
Культивирование вирусов проводится для их выделения и накопления с диагностическими целями, для последующего их изучения, для получения биологических препаратов, для изучения вирусного онкогенеза и патогенеза вирусных инфекций.
Вирусы являются строгими внутриклеточными паразитами и для их культивирования применяются (при строгом контроле) три метода:
1) в организме восприимчивого животного;
2) в развивающемся курином эмбрионе;
3) в культуре клеток.
В вирусологической практике для культивирования вирусов используют преимущественно новорожденных животных, поскольку они более чувствительны к вирусам. Этот метод имеет ограниченное применение, поскольку вирусы обладают очень выраженным специфическим тропизмом.
Куриные эмбрионы используются для культивирования только некоторых вирусов – гриппа, герпеса, натуральной и обезьяней оспы, паротита.
Наиболее широко в вирусологической практике для культивирования вирусов используются клетки культур тканей. Эти клетки по числу жизнеспособных генераций можно подразделить на три группы:
1. Первичные;
2. Перевиваемые;
3. Полуперевиваемые.
К первичным культурам относятся культуры клеток, способные выдерживать не более 5 – 10 пассажей. Их готовят преимущественно из эмбриональных тканей: почечной ткани эмбриона человека и обезьян, амниона человека, куриного эмбриона, эмбриона мышей, а также из почек взрослых обезьян.
К полуперевиваемым культурам клеток относятся культуры диплоидных клеток, получаемых из фибробластов человеческого эмбриона. Эти клетки выдерживают до 150 генераций, сохраняя исходный диплоидный набор хромосом. Диплоидные клетки нашли широкое применение в вирусологии.
Перевиваемые культуры получают преимущественно из опухолевых клеток одного типа, хорошо размножающихся in vitro в течение длительного времени. К таким клеткам относятся линии, ведущие свое начало от карцином человека (HeLa, Hep -2 и др.). Основное преимущество перевиваемых линий перед первичной культурой клеток состоит в их способности размножаться в лабораторных условиях в течение длительного срока в многочисленных генерациях.
Для выращивания культур клеток любого типа необходимы питательные среды. Наиболее широкое применение нашла среда 199. В состав этой среды входят минеральные соли, глюкоза, аминокислоты, витамины, ко – ферменты и многие другие компоненты. Кроме того, в питательную среду обязательно вносят сыворотку крови и буферные растворы для поддержания стабильного рН. Чтобы предотвратить бактериальное загрязнение, в среду добавляют антибиотики.
Выращивание микроорганизмов
Казахстанско-Российский медицинский университет
Кафедра Микробиологии с основами иммунологии
СРС
На тему: ПРИНЦИПЫ КУЛЬТИВИРОВАНИЯ БАКТЕРИЙ
Выполнила: Ильясова А.М.
Факультет: стоматологический гр. 206
Алматы 2014.
ПРИНЦИПЫ КУЛЬТИВИРОВАНИЯ БАКТЕРИЙ
Микроорганизмы (за исключением облигатных внутриклеточных паразитов — риккетсий, хламидий, вирусов и простейших) культивируют, как правило, на искусственных питательных средах. В зависимости от пищевых потребностей того или другого вида питательные среды должны содержать соответствующие исходные вещества, необходимые для пластического и энергетического метаболизма.
Выделение микроорганизмов из различных материалов и получение их культур широко используется в лабораторной практике для микробиологической диагностики инфекционных заболеваний, в научно-исследовательской работе и в микробиологическом производстве вакцин, антибиотиков и других биологически активных продуктов микробной жизнедеятельности.
Условия культивирования также зависят от свойств соответствующих микроорганизмов. Большинство патогенных микробов выращивают на питательных средах при температуре 37 °С в течение 1—2 сут. Однако некоторые из них нуждаются в более длительных сроках. Например, бактерии коклюша — в 2—3 сут, а микобактерии туберкулеза — в 3—4 нед.
Для стимуляции процессов роста и размножения аэробных микробов, а также сокращения сроков их выращивания используют метод глубинного культивирования, который заключается в непрерывном аэрировании и перемешивании питательной среды. Глубинный метод нашел широкое применение в биотехнологии.
Для культивирования анаэробов применяют особые методы, сущность которых заключается в удалении воздуха или замены его инертными газами, в герметизированных термостатах — анаэростатах. Анаэробов выращивают на питательных средах, содержащих редуцирующие вещества (глюкозу, муравьинокис-лый натрий и др.). уменьшающиеокислительно-восстановительный потенциал.
Выращивание микроорганизмов
Питательные среды должны бытьтакими, что легко усваиваются, с определенным составом азотистых веществ, углеводов, витаминов и соответствующей концентрацией солей, изотоническими, стерильными, иметь буферные свойства, оптимальную вязкость и определен окислительно восстановительный потенциал.
Микроорганизмы, которые нуждаются в высоких концентрациях солей, называют галофильними.Они распространены в морях, океанах, соленых озерах. К ним принадлежат некоторые патогенные для человека виды (Vibrioparahaemolyticus и др.).
В течение всей истории микробиологии питательные среды постепенно совершенствовались. В допастеровский период как среды для выращивания микроорганизмов применяли только настои и отвары. Л. Пастер и К. Негели внедрили в практику культивирования безбелковые среды.
Р. Кох и Ф. Леффлер для выращивания бактерий использовали мясную воду, пептон и натрия хлорид. Эта среда являет собой мясо-пептонный бульйон (МПБ), из которого готовят мясо-пептонныйагар (МПА), добавляя 1—2 % агара.
Агар — твердый волокнистый материал, который добывают из некоторых водорослей. В водных растворах он образует густой гель (студень). Агар состоит из 70—75 % полисахаридов, 2—3 % белков и других азотсодержащих веществ, 2—4 % золы. Основными компонентами агараявляются высокомолекулярные вещества — агароза и агаропептин. Агар растворяется в воде при нагревании и охлаждается при комнатной температуре. Его выпускают в виде бесцветных пластинок или порошка. Благодаря свойству агара предоставлять питательному субстрату при охлаждении консистенцию густого геля и высокой стойкости к ферментативному действию микроорганизмов его широко применяют при изготовлении полужидких, плотных и сухих питательных сред.
Разработана методика изготовления синтетического полимерного материала, который используется для приготовления густых питательных сред и с успехом заменяет естественный дефицитный агар.
Требования к питательным средам. Для выращивания бактерий в лабораторных условиях, исследования их разнообразных свойств, длительного хранения используют питательные среды. Они должны отвечать определенным стандартам, создавая оптимальные условия для роста, размножения и жизнедеятельности микроорганизмов.
В первую очередь, бактерии нуждаются в азоте, углероде и водороде для построения собственных белков. Водород и кислород для клеток поставляет вода. Источником азота выступают многочисленные вещества, в основном, животного происхождения (мясо говяжье, рыба, мясо-костная мука, казеин), а также белковые гидролизаты, пептиды, пептоны. Можно использовать и заменители мяса – плаценту, кровяные сгустки, дрожжи. Следовательно, в состав сред должны быть введены источники питательных веществ и вода, а также ростовые факторы (витамины группы В, ферменты). Универсальным источником их служат экстракты из белков животного и растительного происхождения, белковые гидролизаты. Для микробов с более сложными пищевыми потребностями в состав сред включают нативные субстраты – кровь, сыворотку, асцитическую жидкость, яичный желток, кусочки печенки, почек, мозговой ткани и др.
Среды должны быть сбалансированными за микроэлементным составом и содержать ионы железа, меди, марганца, цинка, кальция, натрия, калию, иметь в своем составе неорганические фосфаты.
Допускается применение веществ, которые устраняют действие ингибиторов роста и токсиноутвореннямикробов (отдельные аминокислоты, твіни, активирован уголь и тому подобное). Важной является стабилизация оптимума рН среды, его высокой буферності и уровень окислительно восстановительного потенциала (Еh), который для аеробних микроорганизмов достигает свыше 0,08 В, а для анеробних бактерий колеблется в пределах 0,12-0,60 В.
Среды должны иметь определенную вязкость, плотность, иметь определенную влажность (до 20 % воды), быть изотоническими, прозрачными и обязательно стерильными.
Oсновныетребования к питательнымсредам:
3. лёгкая усвояемость
4. определенный состав азотистых веществ, углеводов, витаминов,
6. определённая вязкость и окислительно-восстановительный баланс
Основные питательные среды. Многочисленные потребности микроорганизмов предопределяют большое разнообразие питательных сред, а для отдельных видов бактерий существуют специальные среды. Часть их готовят в лабораториях непосредственно перед посевом, но с каждым годом появляются все новые и новые среды заводского изготовления (сухие), которые способны удовлетворить самые прихотливые потребности микробиологов. Они сохраняются длительное время, имеют стандартный состав.
Среды разделяются на естественные и искусственные. Как естественные используют свернутую сыворотку, молоко, яйца, мышечную ткань. Искусственные среды создают путем комбинирования разнообразных субстратов, которые обеспечивают те или другие потребности микроорганизмов. Их используют в основном для экспериментального изучения отдельных звеньев метаболизма бактерий.
В зависимости от своей плотности, среды разделяются на жидкие, полужидкие и плотные. Полужидкие и плотные среды готовятся из жидких, добавляя соответственно 0,3-0,7 % но 1,5-2,0 % агара. Последний представляет собой волокнистый материал, который добывают из морских водорослей. Состоит он из полисахаридов (70-75 %), белков (2-3 %), основными составляющими частями является высокомолекулярные агароза и агаропептин. Агар растворяется в воде при повышенной температуре, а, застигая, предоставляет среде драглеподібної консистенции и стойкости к ферментным системам бактерий. Именно за эти свойства он приобрел широкое распространение в микробиологической практике. Для создания плотных сред используют также желатин (10-15 %), свернутую сыворотку крови.
Рост культур на различных средах
Рост в жидких средах. При выращивании в жидких средах микроорганизмы вызывают их помутнение, образуют осадок, кольцо, «островки» пленки или цельную пленку. Рост в виде пленки характеризует способность клеток объединяться в мицелиальные структуры (дрожжи, плесени). Пленка может быть тонкой тусклой, иногда сморщенной и всползающей на стенки пробирки, или блестящей, влажной при длительном культивировании. У микроорганизмов, образующих истинный мицелий, формируется толстая прочная пленка, которая впоследствии может превращаться в слизистую массу.
Рост на агаризованных средах. Выращенные на агаризованных питательных средах культуры по консистенции могут быть пастообразными, маслянистыми, слизистыми, рыхлыми, крошащимися, тянущимися, волокнистыми, кожистыми. Цвет штриха зависит от образования некоторых пигментов, как внутриклеточных, так и выделяющихся в среду культивирования.
Культуральные признаки основных видов микроорганизмов, влияющих на качество продуктов
Пищевые продукты во время хранения подвергаются порче в результате попадания и развития в них различных сапрофитных микроорганизмов. Видовой состав микроорганизмов весьма разнообразен: гнилостные бактерии, микрококки, молочнокислые, маслянокислые, уксуснокислые, пропионовокислые бактерии, плесневые грибы, дрожжи, актиномицеты.
Наряду с сапрофитами в продуктах могут содержаться патогенные и условно-патогенные микроорганизмы – возбудители зооантропонозных болезней, пищевых токсикоинфекций и токсикозов.
Гнилостные микроорганизмы развиваются в продуктах, а также в кишечнике человека и животных. Они вызывают распад белков с образованием токсичных продуктов распада, что может привести к возникновению различных пороков пищевых продуктов: неприятный запах, ослизнение. Употребление таких продуктов приводит к острым пищевым отравлениям. К гнилостным бактериям относят аэробные спорообразующие и неспорообразующие палочки, спорообразующие анаэробы, факультативно-анаэробные неспорообразующие палочки.
Аэробные спорообразующие палочки. Типичные представители — палочки цереус, грибовидная, капустная, картофельная и сенная.
Палочка цереус (Вас. cereus) — это грамположительная палочка длиной 8 мкм, шириной 0,9-1,5 мкм, подвижная, образует споры (рис.5). Отдельные штаммы этого микроорганизма могут формировать капсулу. Может развиваться и при недостатке кислорода воздуха.

Рис. 5. Грибовидная палочка (Вас. cereus):
На поверхности МПА вырастают крупные колонии с изрезанными краями, некоторые штаммы выделяют розово-коричневый пигмент; на кровяном агаре вокруг колоний наблюдается резко очерченная зона гемолиза. При развитии микроорганизм образует нежную пленку, пристеночное кольцо, равномерное помутнение и хлопьевидный осадок на дне пробирки.
Все штаммы интенсивно растут при рН (9-9,5), при рН (4,5-5) прекращают свое развитие. Могут развиваться при концентрации поваренной соли в среде 10-15 %, сахара — до 30-60 %. Оптимальная температура развития (30-32)°С. Палочка свертывает и пептонизирует молоко, быстро разжижает желатин, способна образовывать ацетилметилкарбинол, утилизировать цитратные соли, ферментировать мальтозу и сахарозу. Некоторые штаммы расщепляют лактозу, галактозу, инулин, арабинозу, глицерин.
Капустная палочка (Вас. megatherium) — это грамположительная палочка длиной 3,5-7 мкм и шириной 1,5- 2 мкм. Она располагается одиночно, попарно или цепочками, подвижна, образует споры, капсул не формирует. На МПА вырастают колонии серо-белого цвета, гладкие, блестящие с ровными краями. Капустная палочка вызывает помутнение МПБ с образованием незначительного осадка. Микроб чувствителен к кислой реакции среды. Оптимальная температура развития 25-30 о С. Палочка быстро разжижает желатин, свертывает и пептонизирует молоко, вызывает гемолиз эритроцитов, гидролиз крахмала. На средах с глюкозой и лактозой микроб дает кислую реакцию. При развитии капустной палочки выделяются сероводород, аммиак, но индола не образуется.
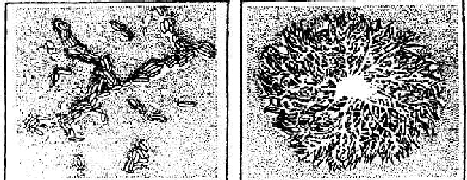
Рис. 6. Картофельная палочка (Вас. mesentericus):
а — клетки; б — колония
Картофельная палочка (Вас. mesentericus) — это грубая грамположительная палочка с закругленными концами, длиной 1,6-6 и шириной 0,5-0,8 мкм (рис. 6), образует споры, капсул не формирует, подвижна. Картофельная палочка на МПА образует сочные, с морщинистой поверхностью слизистые колонии серо-белого цвета с волнистыми краями. Микроб разжижает желатин, свертывает и пептонизирует молоко, вызывает гидролиз крахмала, выделяет при развитии сероводород, индола не образует, не ферментирует глюкозы и лактозы.
Сенная палочка (Вас. subtilis) — это грамположительная короткая палочка с закругленными концами длиной 3-5, шириной 0,6 мкм, иногда располагается цепочками, образует споры, капсул не образует, подвижна. На МПА вырастают сухие бугристые колонии серо-белого цвета. При росте в МПБ появляется сухая, морщинистая беловатая пленка; бульон сначала мутнеет, а затем становится прозрачным. Микроб чувствителен к кислой реакции среды. Оптимальная температура развития 37 о С. Может развиваться и при (5-20) о С.
Палочка характеризуется высокой протеолитической активностью: разжижает желатин и свернутую кровяную сыворотку, свертывает и пептонизирует молоко, выделяет аммиак, иногда сероводород, но не образует индола, вызывает посинение лакмусового молока и гидролиз крахмала, разлагает глицерин, дает кислую реакцию на средах с лактозой, глюкозой, сахарозой.
Аэробные неспорообразующие палочки. К этой группе микроорганизмов относятся чудесная, флуоресцирующая, синегнойная палочки.
Флуоресцирующие бактерии (рис. 7) характеризуются высокой ферментативной активностью: разжижают желатин и свернутую кровяную сыворотку, свертывают и пептонизируют молоко; большинство их штаммов способны расщеплять клетчатку и крахмал.
При развитии они образуют сероводород и аммиак, не выделяют индола, глюкозы и лактозы не ферментируют. Бактерии вызывают посинение лакмусового молока. Многие штаммы флуоресцирующих бактерий продуцируют ферменты липазу, лецитиназу; дают положительную реакцию на каталазу, цитохромоксидазу, оксидазу. Флуоресцирующие бактерии – сильные аммонификаторы.

Рис. 7. Флуоресцирующая палочка (P. fluorescehs)
Синегнойная палочка (P. aeruginosa) — это грамотрицательная небольшая палочка длиной 2-3, толщиной 0,6 мкм, спор и капсул не формирует, подвижная. На МПА вырастают расплывчатые, непрозрачные, окрашенные в зеленовато-синий или бирюзово-синий цвет колонии. Цвет колоний обусловлен образованием пигментов (желтого — флуоресцина и голубого — пиоцианина). Микроб вызывает помутнение МПБ и выделяет пигменты, иногда на поверхности среды появляется пленка. Пигменты растворимы в хлороформе. Как и все гнилостные бактерии, синегнойная палочка чувствительна к кислой реакции среды, оптимальная температура ее развития 37 °С. Микроб быстро разжижает желатин и свернутую кровяную сыворотку, свертывает и пептонизирует молоко, вызывает посинение лакмусового молока, образует аммиак и сероводород, но не выделяет индола.
Синегнойная палочка обладает липолитической способностью. Она дает положительные реакции на каталазу, оксидазу, цитохромоксидазу (эти свойства присущи представителям рода псевдомонас). Некоторые штаммы микроорганизма расщепляют крахмал и клетчатку, но не ферментируют лактозы и сахарозы.
Спорообразующие анаэробы. К спорообразующим анаэробам относят палочки путрификус и спорогенес.
Палочка путрификус (Cl. putrificus) – это грамположительная палочка длиной 7-9 и шириной 0,4-0,7 мкм, иногда формирует цепочки, образует довольно термоустойчивые споры, превышающие диаметр вегетативной формы, капсул не образует, подвижная. Колонии на МПА имеют вид клубка волос, непрозрачные, вязкие, при росте в МПБ вызывают его помутнение.
Протеолитические свойства микроорганизма ярко выражены: разжижает желатин и кровяную сыворотку, свертывает и пептонизирует молоко. Палочка путрификус образует сероводород, аммиак, индол; вызывает почернение мозговой среды, на кровяном агаре вокруг колоний образуются зоны гемолиза; характеризуется липолитической активностью, но не обладает сахаролитическими свойствами.
Палочка спорогенес (Cl. sporogenes) — это крупная палочка с закругленными концами длиной 3-7 и шириной 0,6-0,9 мкм. В мазках она располагается одиночно или формирует цепочки. Палочка спорогенес быстро образует споры, которые сохраняют жизнеспособность после 30-минутного нагревания на водяной бане, а также после 20-минутного выдерживания в автоклаве при 120°С, капсул не образует. Микроб подвижный, грамположительный. На МПА вырастают мелкие вначале прозрачные колонии, по мере старения культуры они становятся непрозрачными. Оптимальная температура роста микроорганизма 37°С, но может расти и при 50 ° С. Палочка спорогенес обладает очень сильной протеолитической активностью: вызывает гнилостный распад белков с образованием газов; разжижает желатин и свернутую кровяную сыворотку, свертывает и пептонизирует молоко. Микроорганизм образует сероводород, разлагает с образованием кислоты и газа галактозу, мальтозу, декстрин, левулезу, маннит, сорбит, глицерин.
Факультативно-анаэробные неспорообразующие палочки. К ним относят палочку протея обыкновенного (Proteus vulgaris) и кишечную палочку (Escherichia coli).
Палочка протея (Рг. vulgaris) обладает полиморфностью, т.е. может образовывать нити длиной 1;2-3 и шириной 0,5-0,6 мкм. Спор и капсул не формирует. Палочка обладает активной подвижностью (перитрихи), грамотрицательна (рис. 8). При посеве материала, содержащего палочку протея, в конденсационную воду свежескошенного агара (метод Шукевича) через несколько часов отмечается роение микроба, ползучий рост (Н-форма). Поверхность МПА покрывается тонкой нежной, прозрачной пленкой. Посев по методу Шукевича широко применяют в диагностических лабораториях при выделении палочки протея из объектов внешней среды и продуктов. Этот микроорганизм сбраживает глюкозу с образованием кислоты и газа, но не ферментирует лактозы и маннита. Расщепляет мочевину, разжижает желатин, выделяет сероводород, образует индол, сбраживает мальтозу.

Рис. 8. Палочка протея обыкновенного (Pr. Vulgaris)
К ишечная палочка (Е. coli) — это короткая (длина 1-3, ширина 0,5-0,8 мкм), полиморфная, грамотрицательная, не образующая спор, подвижная палочка (рис. 9). Хорошо растет на простых питательных средах: на МПА — колонии прозрачные, с серовато голубым отливом, легко сливающиеся между собой. В МПБ микроорганизм дает обильный рост при значительном помутнении среды, образует пристеночное кольцо, пленка на поверхности бульона обычно отсутствует. На плотной дифференциально-диагностической среде Эндо, содержащей лактозу, кишечная палочка образует плоские красные колонии с темным металлическим блеском. Не разжижает желатина, не дает роста на средах, содержащих лимонную кислоту или ее соли, свертывает молоко, расщепляет пептоны с образованием аминов, аммиака, сероводорода, индола, обладает высокой ферментативной активностью по отношению к лактозе, глюкозе и другим сахарам, а также спиртам.
ишечная палочка (Е. coli) — это короткая (длина 1-3, ширина 0,5-0,8 мкм), полиморфная, грамотрицательная, не образующая спор, подвижная палочка (рис. 9). Хорошо растет на простых питательных средах: на МПА — колонии прозрачные, с серовато голубым отливом, легко сливающиеся между собой. В МПБ микроорганизм дает обильный рост при значительном помутнении среды, образует пристеночное кольцо, пленка на поверхности бульона обычно отсутствует. На плотной дифференциально-диагностической среде Эндо, содержащей лактозу, кишечная палочка образует плоские красные колонии с темным металлическим блеском. Не разжижает желатина, не дает роста на средах, содержащих лимонную кислоту или ее соли, свертывает молоко, расщепляет пептоны с образованием аминов, аммиака, сероводорода, индола, обладает высокой ферментативной активностью по отношению к лактозе, глюкозе и другим сахарам, а также спиртам.

Рис. 9. Кишечная палочка (Е. coli)
Грибы. В природе насчитывается более 100 тыс. видов грибов (рис 10). В основном это сапрофиты, микроорганизмы не развиваются на живых существах. Плесневые грибы и многие виды дрожжей могут быть возбудителями пороков пищевых продуктов.
Плесневые грибы. Они являются постоянными обитателями внешней среды, на поверхности субстрата образуют ползучие, стелющиеся, бархатистые, пушистые, войлокообразные колонии, которые сливаются в сплошной налет. Наиболее благоприятные условия для развития плесневых грибов — свободный доступ кислорода и кислая реакция среды. Они могут развиваться при влажности окружающей среды 10-15%, рН 1,5-11, температуре до -11°С (из рода мукоровых), высоком осмотическом давлении, а отдельные виды плесневых грибов — при ограниченном доступе кислорода. Плесневые грибы обладают ферментативной активностью (протеолитической, липолитической и др.), вызывают глубокий распад белков и белковых веществ, разлагают жиры до жирных кислот и альдегидов. При их развитии на мясе происходит его ослизнение и плесневение, сопровождающиеся химическими превращениями, которые обусловливают изменение его запаха и вкуса. Снижается товарный вид мяса.
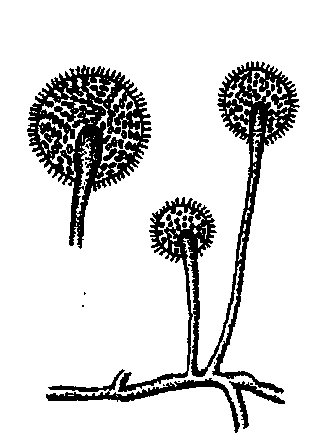

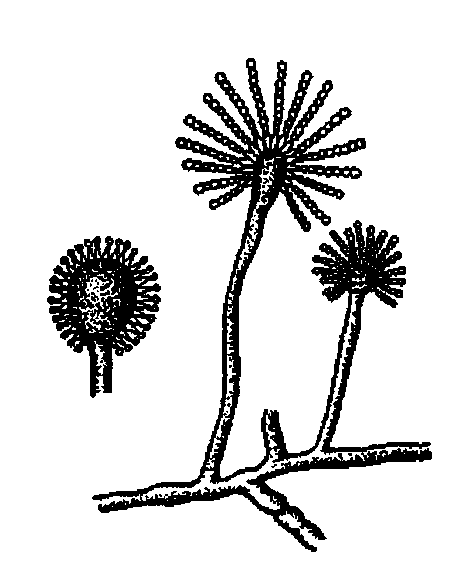

Рис. 10 Морфологические особенности грибов различных классов:
а — Mucor; б — Penicillium; в — Aspergillus; г — Alternaria
Д рожжи. Это факультативные анаэробы, лучше развиваются в кислой среде, оптимальная температура роста 20-30° С, но многие из них способны развиваться и при -10 °С. Вегетативные формы дрожжей погибают при 60-65°С, а споры — при 70-75 °С. Дрожжи распространены во внешней среде, откуда попадают на продукты. Различные виды дрожжей сбраживают большинство углеводов (глюкозу, лактозу, сахарозу, декстрозу, мальтозу). Микроорганизмы рода микодерма (Mycoderma), не сбраживающие углеводов, получили название пленчатых дрожжей. Клетки пленчатых дрожжей имеют вытянутую форму. Эти дрожжи широко распространены в природе, попадая на продукты, вызывают их порчу. Так, развиваясь на мясе, дрожжевые клетки используют молочную кислоту, изменяют рН мяса, а также портят его товарный вид. При расщеплении жиров образуются свободные жирные кислоты, что ведет к прогорканию продукта. Многие дрожжи обладают липолитической способностью. Гнилостной порчи эти микроорганизмы не вызывают, но в результате плесневения и ослизнения мяса сокращаются сроки его хранения в охлажденном и замороженном состоянии.
рожжи. Это факультативные анаэробы, лучше развиваются в кислой среде, оптимальная температура роста 20-30° С, но многие из них способны развиваться и при -10 °С. Вегетативные формы дрожжей погибают при 60-65°С, а споры — при 70-75 °С. Дрожжи распространены во внешней среде, откуда попадают на продукты. Различные виды дрожжей сбраживают большинство углеводов (глюкозу, лактозу, сахарозу, декстрозу, мальтозу). Микроорганизмы рода микодерма (Mycoderma), не сбраживающие углеводов, получили название пленчатых дрожжей. Клетки пленчатых дрожжей имеют вытянутую форму. Эти дрожжи широко распространены в природе, попадая на продукты, вызывают их порчу. Так, развиваясь на мясе, дрожжевые клетки используют молочную кислоту, изменяют рН мяса, а также портят его товарный вид. При расщеплении жиров образуются свободные жирные кислоты, что ведет к прогорканию продукта. Многие дрожжи обладают липолитической способностью. Гнилостной порчи эти микроорганизмы не вызывают, но в результате плесневения и ослизнения мяса сокращаются сроки его хранения в охлажденном и замороженном состоянии.
Актиномицеты. Большинство видов актиномицетов хорошо развиваются при 25-30° С, для патогенных видов температурный оптимум составляет 37-40°С. Актиномицеты широко распространены в природе — это одни из многочисленных гнилостных микроорганизмов. Они способны вызывать гниение белковых субстратов, гидролиз жира. Развиваясь на мясе при -2-3°C , актиномицеты придают ему неприятный землистый запах.
Микрококки. Семейство микрококки (Micrococcaceae) включает роды: микрококкус (Micrococcus), стафилококкус (Staphylococcus), capцина (Sarcina). Кокки этого семейства обычно имеют форму шара. Большинство представителей семейства микрококкацее — аэробы и факультативные анаэробы. Небольшое число видов относится к облигатным анаэробам. Микроорганизмы семейства микрококкацее широко распространены в природе. Наряду с сапрофитными обнаруживаются и патогенные виды, которые могут вызвать различные патологические процессы в организме человека и животного, а также быть причиной пищевых отравлений. Микрококки — строгие аэробы в отличие от стафилококков. На МПА образуют средней величины круглые белого, желтого или розового цвета колонии. Встречаются также различные оттенки от красного до оранжевого цвета. Большинство сапрофитов выделяют розовый и желтый пигменты. Оптимальная температура развития 20-25° С. Многие виды могут развиваться при 5-8°С. Микрококки характеризуются высокой устойчивостью к соли и сахару, относятся к пептонизирующим микроорганизмам. Некоторые виды разлагают жир и придают продукту прогорклый вкус.
Микробактерии. Мелкие палочки неправильной формы, при окрашивании метиленовым синим наблюдается зернистость. Палочки развиваются при 15-35° С; оптимальная температура роста 30 °С: Эти микроорганизмы являются наиболее устойчивыми к высокой температуре из всех известных бесспоровых бактерий.
Маслянокислые бактерии. Представляют собой палочки цилиндрической формы, длиной от 5-7 до 7-12 мкм и толщиной 0,5-1,5 мкм (рис. 11). Бактерии подвижны, образуют споры (клостридии), капсул не образуют. Споры выдерживают кипячение 1-2 мин, не погибают при пастеризации. Маслянокислые бактерии по Граму красятся положительно, содержат гранулезу (крахмалоподобное вещество), являются анаэробами. Оптимальная температура развития бактерий 30-35°С, минимальная 8-10, максимальная 45 °С. Характерными признаками этих бактерий являются бурное газообразование при развитии, неприятный запах масляной кислоты. Маслянокислые бактерии сбраживают молочный сахар и расщепляют соли молочной кислоты. При этом образуются масляная, уксусная, пропионовая, муравьиная кислоты и небольшое количество спирта (этилового, бутилового, пропилового). Маслянокислые бактерии способны усваивать белковый, аминокислотный и аммонийный азот, а некоторые виды — даже азот воздуха. Они чувствительны к кислой реакции среды.
Р ис. 11. Маслянокислые бактерии
ис. 11. Маслянокислые бактерии
Уксуснокислые бактерии. Уксуснокислые бактерии представляют собой палочки, не образующие спор, подвижные (встречаются и неподвижные), располагаются одиночно или цепочками. Это строгие аэробы. Оптимальная температура развития бактерий 30°С. Колонии уксуснокислых бактерий вырастают только на поверхности питательной среды, на жидких питательных средах они образуют пленку (на поверхности свернувшегося молока появляется оранжевое кольцо). При доступе воздуха бактерии легко окисляют спирт в уксусную кислоту. Возбудителями уксуснокислого брожения являются бактериум ацети (Bact. aceti), бактериум орлеанзе (Bact. orleanse) и др.
Исследовательская работа «Анализ условий питательной среды для бактерий»

Полезные и опасные, милые и ужасные, смертоносные и дающие жизнь. Они вокруг и их невозможно увидеть. Непросто отыскать более интересный объект для исследований. По количеству невероятных сюжетов мир бактерий можно сравнить с миром привидений. Но в отличие от изучения привидений, из информации о бактериях можно извлечь массу практической пользы, чем научное сообщество и занимается вот уже более ста лет.
Проблема заключается в том, что микроорганизмы распространены повсеместно. Все живые существа — растения, животные и люди — постоянно взаимодействуют с микробами, являясь часто не только их хранилищами, но и распространителями. Ни сверхнизкие температуры Антарктики, ни кипящие струи гейзеров, ни насыщенные растворы солей в соляных бассейнах, ни сильная инсоляция горных вершин, ни резкие колебания кислотности среды, ни многое другое не мешают существованию и развитию микрофлоры в природных субстратах. Взаимодействие человека с бактериальной микрофлорой неизбежно, а его характер зависит от биологической и экологической грамотности человека. Это делает актуальной тему исследования «Анализ условий питательной среды для бактерий».
Цель исследования: изучение условий среды, способствующей росту и размножению бактерий.
Скачать:
| Вложение | Размер |
|---|---|
| bakterii.docx | 334.72 КБ |
Предварительный просмотр:
Управление образования администрации города Черемхово
Муниципальное общеобразовательное учреждение
Анализ условий питательной среды для бактерий
Вид работы: исследовательская
Автор: обучающаяся 8 класса
Булгакова Светлана Владимировна,
1. Питательные среды для размножения бактерий: условия, виды
1.1. Бактерии и условия их культивирования
1.2. Принципы культивирования бактерий
1.3. Основные питательные среды.
2.Влияние окружающей среды на микроорганизмы
3. Проведение бактериологического исследования
3.1. Организация проведения бактериологического исследования
3.2. Результаты бактериологического исследования
Список использованных источников
Полезные и опасные, милые и ужасные, смертоносные и дающие жизнь. Они вокруг и их невозможно увидеть. Непросто отыскать более интересный объект для исследований. По количеству невероятных сюжетов мир бактерий можно сравнить с миром привидений. Но в отличие от изучения привидений, из информации о бактериях можно извлечь массу практической пользы, чем научное сообщество и занимается вот уже более ста лет .
Учёные прогнозируют, что результаты изучения жизни бактерий в будущем приведут к:
- открытию секрета долголетия и даже бессмертия (во льдах найдены бактериальные сообщества, в которых обнаружены представители возрастом более миллиона лет);
- получению альтернативных источников энергии, в том числе и пищи;
- получение новых материалов биологического происхождения;
- формированию новых экосистем.
Любое открытие в микробиологии сразу же подхватывается промышленниками, которые внедряют новые технологии в современное производство и предлагают результаты рынку.
Знакомясь с новинками, человек получает возможность не только оперировать более значительным объемом средств в достижении утилитарных целей, но и самостоятельно заглянуть в прошлое планеты Земля и в ее будущее.
Проблема заключается в том, что микроорганизмы распространены повсеместно. Все живые существа — растения, животные и люди — постоянно взаимодействуют с микробами, являясь часто не только их хранилищами, но и распространителями. Ни сверхнизкие температуры Антарктики, ни кипящие струи гейзеров, ни насыщенные растворы солей в соляных бассейнах, ни сильная инсоляция горных вершин, ни резкие колебания кислотности среды, ни многое другое не мешают существованию и развитию микрофлоры в природных субстратах. Взаимодействие человека с бактериальной микрофлорой неизбежно, а его характер зависит от биологической и экологической грамотности человека. Это делает актуальной тему исследования «Анализ условий питательной среды для бактерий».
Цель исследования : изучение условий среды, способствующей росту и размножению бактерий.
- Получить представление о бактериях и условиях их культивирования;
- Рассмотреть виды питательных сред для размножения бактерий;
- Понять особенности размножения бактерий на жидких и плотных питательных средах;
- Раскрыть влияние факторов окружающей среды на микроорганизмы;
- Провести бактериологическое исследование.
Объект исследования : бактерии.
Предмет исследования : рост бактерий на различных питательных средах.
Гипотеза : скорость размножения микроорганизмов помимо видовой принадлежности зависит от состава питательной среды, рН, температуры, аэрации и других факторов.
Методы исследования: поисковый метод; наблюдение; анализ, синтез, сравнение; обобщение.
Научная значимость исследования заключается в расширении аппарата для решения заданий ЕГЭ . Практическая значимость исследования состоит в том, что его материалы могут быть использованы в образовательной деятельности по биологии, для проведения занятий в кружке, факультативных занятий.
Бактерии и их размножение привлекло внимание учёных со времён Левенгука, когда он впервые увидел их в микроскоп. В 1850-х годах Луи Пастер положил начало изучению физиологии и метаболизма бактерий, а также открыл их болезнетворные свойства. Это послужило возникновению микробиологии – науки, которая
В разное время изучением бактерий занимались Гусев М. В.и Минеева Л. А., Заварзин Г. А., Герхардт Ф . и др. учёные микробиологи.
Рассмотрим наиболее значимые на современном этапе развития микробиологии научные труды, посвящённые питательным для бактерий средам.
К. Френкель в своей монографии «Основы учения о бактериях» [1] подробно охарактеризовал питательные среды, принципы их классификации, требования, предъявляемые к питательным средам, условия культивирования микроорганизмов.
H. В. Прозоркина, П. А. Рубашкина. Свой труд «Основы микробиологии, вирусологии и иммунологии» посвятили описанию методов микробиологических исследований [2] . Эти труды и послужили методологической основой для нашего исследования.
- Питательные среды для размножения бактерий: условия, виды
- Бактерии и условия их культивирования
1.Размножение бактерий на жидких и плотных питательных средах
Бактерии, как правило, характеризуются высокой скоростью размножения по сравнению с другими прокариотами. Скорость их размножения, помимо видовой принадлежности, зависит от состава питательной среды, рН, температуры, аэрации и других факторов. На плотных питательных средах бактерии образуют скопления клеток, называемые колониями. Внешний вид колоний у многих бактерий настолько характерен, что может служить одним из дифференциальных признаков для их идентификации. Колонии разных видов отличаются по своим размерам, форме, поверхности, окраске, прозрачности и др. Однако эти признаки могут изменяться в зависимости от условий культивирования.
На жидких средах рост бактерий характеризуется образованием пленки на поверхности питательной среды, равномерного помутнения, либо осадка.
Размножение бактерий определяется временем генерации, т. е. периодом, в течение которого осуществляется деление клетки. Продолжительность генерации зависит от вида бактерий, возраста, популяции, состава питательной среды, температуры и других факторов. В оптимальных условиях время генерации у разных бактерий колеблется довольно в широких пределах: от 20 минут у кишечной палочки до 14 ч у микобактерий туберкулеза, в связи с чем их колонии образуются через 18 – 20 ч либо через 3 – 5 недели соответственно [3] .
При выращивании бактерий в жидкой питательной среде наблюдается последовательная смена отдельных фаз в развитии популяции, отражающая общую закономерность роста и размножения бактериальных клеток.
Динамика развития бактериальной популяции представлена на рис.1
Рис.1. Динамика развития бактериальной популяции
I — исходная стационарная фаза начинается после внесения бактерий в питательную среду. В течение данной фазы число бактериальных клеток не увеличивается.
II — лаг-фаза , или фаза задержки размножения, характеризуется началом интенсивного роста клеток, но скорость их деления остается невысокой. Две первые фазы можно назвать периодом адаптации бактериальной популяции, продолжительность которого определяется возрастом культуры, а также количеством и качеством питательной среды.
III — лог-фаза , или логарифмическая (экспоненциальная), фаза отличается максимальной скоростью размножения клеток и увеличением численности бактериальной популяции в геометрической прогрессии. Логарифмическая фаза у бактерий с коротким временем генерации продолжается несколько часов.
IV — фаза отрицательного ускорения характеризуется меньшей активностью бактериальных клеток и удлинением периода генерации. Это происходит в результате истощения питательной среды, накопления в ней продуктов метаболизма и дефицита кислорода.
1.2.Принципы культивирования бактерий
Микроорганизмы культивируют, как правило, на искусственных питательных средах. В зависимости от пищевых потребностей того или другого вида питательные среды должны содержать соответствующие исходные вещества, необходимые для пластического и энергетического метаболизма.
Выделение микроорганизмов из различных материалов и получение их культур широко используется в лабораторной практике для микробиологической диагностики инфекционных заболеваний, в научно-исследовательской работе и в микробиологическом производстве вакцин, антибиотиков и других биологически активных продуктов микробной жизнедеятельности. [4]
Условия культивирования также зависят от свойств соответствующих микроорганизмов. Большинство патогенных микробов выращивают на питательных средах при температуре 37 °С в течение 1–2 сут. Однако некоторые из них нуждаются в более длительных сроках. Например, бактерии коклюша – в 2–3 сут, а микобактерии туберкулеза – в 3–4 нед.
Для стимуляции процессов роста и размножения аэробных микробов, а также сокращения сроков их выращивания используют метод глубинного культивирования, который заключается в непрерывном аэрировании и перемешивании питательной среды. Глубинный метод нашел широкое применение в биотехнологии.
Требования к питательным средам . Для выращивания бактерий в лабораторных условиях, исследования их разнообразных свойств, длительного хранения используют питательные среды. Они должны отвечать определенным стандартам, создавая оптимальные условия для роста, размножения и жизнедеятельности микроорганизмов.
В первую очередь, бактерии нуждаются в азоте, углероде и водороде для построения собственных белков. Водород и кислород для клеток поставляет вода. Источником азота выступают многочисленные вещества, в основном, животного происхождения (мясо говяжье, рыба, мясо-костная мука, казеин. Можно использовать и заменители мяса – плаценту, кровяные сгустки, дрожжи. Следовательно, в состав сред должны быть введены источники питательных веществ и вода, а также ростовые факторы (витамины группы В, ферменты). Универсальным источником их служат экстракты из белков животного и растительного происхождения. Для микробов с более сложными пищевыми потребностями в состав сред включают субстраты – кровь, сыворотку, яичный желток, кусочки печенки, почек, мозговой ткани и др. [5]
Среды должны быть сбалансированными за микроэлементным составом и содержать ионы железа, меди, марганца, цинка, кальция, натрия, калию, иметь в своем составе неорганические фосфаты.
Среды должны иметь определенную вязкость, плотность, иметь определенную влажность (до 20 % воды), быть прозрачными и обязательно стерильными.
Oсновные требования к питательным средам: прозрачность; стерильность; лёгкая усвояемость; определенный состав азотистых веществ, углеводов, витаминов; определённая вязкость.
1. 3. Основные питательные среды.
Многочисленные потребности микроорганизмов предопределяют большое разнообразие питательных сред, а для отдельных видов бактерий существуют специальные среды. Часть их готовят в лабораториях непосредственно перед посевом, но с каждым годом появляются все новые и новые среды заводского изготовления (сухие), которые способны удовлетворить самые прихотливые потребности микробиологов. Они сохраняются длительное время, имеют стандартный состав.
Среды разделяются на естественные и искусственные. Для создания естественных сред используют свернутую сыворотку, молоко, яйца, мышечную ткань.
Искусственные среды создают путем комбинирования разнообразных субстратов, которые обеспечивают те или другие потребности микроорганизмов. Их используют в основном для экспериментального изучения отдельных звеньев метаболизма бактерий.
В зависимости от своей плотности, среды разделяются на жидкие, полужидкие и плотные. Полужидкие и плотные среды готовятся из жидких, добавляя соответственно 0,3-0,7 % но 1,5-2,0 % агара. Последний представляет собой волокнистый материал, который добывают из морских водорослей. Состоит он из полисахаридов (70-75 %), белков (2-3 %). Для создания плотных сред используют также желатин (10-15 %), свернутую сыворотку крови.
В зависимости от потребностей бактериологов питательные среды разделяются на пять основных групп (прил.1 таблица 1) .
Первая группа – универсальные (простые) среды. К ним принадлежат мясо-пептонний бульон (МПБ) и мясо-пептоннийагар (МПА). За своим составом, наличием питательных веществ они пригодны для культивирования многих видов бактерий.
Вторая группа – специальные среды. Они используются в тех случаях, когда микроорганизмы не растут на простых. К ним принадлежит кровяной, сывороточный агары, сывороточный бульйон, асцитический бульйон, асцит-агар и другие.
Третья группа – элективные среды, на которых микроорганизмы определенного вида растут быстрее, более интенсивно, опережают в своем развитии другие виды бактерий.
Четвертая группа селективные среды, которые благодаря добавлению определенных компонентов (желчь, краски, антибиотики и др.) способны подавлять развитие одних видов микроорганизмов, но не влияют на другие виды.
Пятая группа – дифференциально-диагностичнеские среды. Это большая группа сред, которые позволяют определить определенные биохимические свойства микроорганизмов и проводить их дифференциацию.
Рис.2.Среда Плоскирева. Рис.3. Среда Левина
2.Влияние окружающей среды на микроорганизмы
Рассмотрим факторы окружающей среды, влияющие на микроорганизмы.
Температура. Низкие температуры бактерии выдерживают сравнительно легко. Культуры микроорганизмов в замороженном виде сохраняются в лабораторных условиях более чем 80 лет. Выделено жизнеспособный микроорганизм из толщи ледников, возраст которых 12 000 лет.
Холерный вибрион не погибает при температуре -32 °С; некоторые виды бактерий хранят жизнеспособность при температуре жидкого воздуха ( -190 °С), жидкого водорода (-253 °С).
Низкие температуры прекращают процессы гниения и брожения. На этом принципе основывается использование в практике ледников, погребов и холодильных установок для хранения пищевых продуктов.
Пагубно действуют на бактерии высокие температуры . Большинство бактерий погибают при температуре 58–60 °С через 30–60 мин, при 100 °С – в течение 2–3 мин. Силикатные бактерии сохраняются жизнеспособными после деяния на них нагревание до 160 °С.
Высушивание . Стойкость микроорганизмов к высушиванию разная. Чувствительные к высушиванию гонококки, менингококки, трепонемы, лептоспиры, гемофильные бактерии, фаги. Холерный вибрион не погибает под воздействием высушивания 2 сутки, шигели– 7, чумная палочка – 8, дифтерийная –30, брюшнотифозная – 70, стафилококки и микобактерии туберкулеза – 90 суток. Высохшая мокрота больных туберкулезом остается заразной 10 месяцев, споры бацилл сибирской язвы сохраняются до 10 годов, плесневых грибов – 20 лет.
Лучевая энергия . Разные виды излучения имеют бактерицидное или стерилизующее действие. К ней принадлежат ультрафиолетовое, рентгеновское, альфа-, бета-, гамма- и нейтронное излучение. Наиболее выраженное бактерицидное действие имеет прямой солнечный луч.
Высокое давление, ультразвук, механическое сотрясение . Воздействие высокого атмосферного давления 10 132,5 – 91 192,5 кПа (100–900 атм) на глубине морей и океанов 1000–10 000 м бактерии переносят легко. Дрожжи хранят свою жизнеспособность при давлению 50 662,5 кПа (500 атм). Некоторые бактерии, дрожжи, плесневые грибы выдерживают давление 303 975 кПа (3000 атм), фитопатогенные вирусы – 506 625 кПа (5000 атм).
Ультразвук имеет бактерицидные свойства, которые используют для стерилизации пищевых продуктов, изготовления вакцин и дезинфекции предметов.
3. Проведение бактериологического исследования
3.1 Организация проведения бактериологического исследования
Особенности подбора питательной среды для бактерий

Бактерии – живые организмы. Выращивать их хоть и трудно, но интересно. Микробиология до сих пор еще не научилась культивировать большую часть известных видов бактерий. Именно получение нужных питательных сред и создание оптимальных условий, обеспечивающих рост микроорганизмов в искусственных условиях, – одна из основных задач этой науки. Бытовой же интерес к культивированию микробов формируется из двух основных составляющих: желания научиться самостоятельно идентифицировать микроорганизмы и попытки использовать их для решения собственных утилитарных задач. Для успешной постановки эксперимента исследователю необходимо выделить чистую культуру и подобрать оптимальную питательную среду для бактерий.
Выделение чистой культуры
В природе бактерии чистыми культурами не живут. В ста случаях из ста они обитают микробными сообществами, которым присуще функциональное разделение ролей. Одни микроорганизмы дают пищу другим, третьи создают условия для существования четвертых и так далее. Такой принцип общежития, увеличивающий жизнеспособность бактерий в окружающей среде, создает определенную трудность для исследователя: необходимость выделения чистой культуры из бактериального сообщества для ее предметного изучения.

Сегодня микробиология использует следующие способы выделения чистых культур:
- Метод Дригальского используется для выделения аэробов (кислорододышащих микроорганизмов). Проводится в несколько этапов, на каждом из которых исследуемое бактериальное сообщество разделяется на более мелкие сообщества. Изучается их рост и характер развития до выделения чистой культуры.
- Метод Коха, при котором для выделения чистых культур используется бактериологическая петля и полурасплавленный агар-агар. Внутрь вязкого агар-агара бактериологической петлей поселяют колонию, при этом хорошенько размешивают ее по всей поверхности. После того, как агар-агар застывает, делают еще три-четыре разведения, материал для которого берется в каждой новой партии. К последнему разведению в агар-агаре содержится уже минимальное количество бактерий, пригодных для выделения. Изолированную колонию переселяют на свежую питательную среду.
- Метод Вейнберга. Применяется для выделения анаэробных микроорганизмов. Используется с применением анаэростата. Бактерий разводят по методу Коха 6-7 раз, после каждого разведения отправляют в анаэростат. Последнюю пробирку со средой и с бактериальной колонией быстро охлаждают и заливают парафином с вазелиновым маслом, которые перекрывают доступ кислорода в пробирку. В результате колония анаэробных микроорганизмов растет под наблюдением исследователя, который всегда может изучить поселение в пробирке и определить рост колонии, а также характер ее развития.
Внешне чистая культура представляет собой однородный обособленный нарост на питательной среде для бактерий. Такие иногда можно увидеть на испорченных продуктах питания. Считается, что именно в одном таком обособленном наросте обитают бактерии, произошедшие из одной бактериальной клетки.

Микробиология за свою историю изобрела много способов для выделения чистых бактериальных культуры. Многие из них невозможно использовать в домашних условиях. И это при том, что даже для использования простых способов выделения чистых культур исследователю придется приобретать определенное количество лабораторных приспособлений. Но если простые чашки Петри, трубки Бурри и тот же анаэростат приобрести вполне по силам, то многие другие лабораторные установки требуют капитальных финансовых вложений.
Культивирование колоний микроорганизмов: принципы
После выделения чистой колонии исследователь должен определить наилучшие условия для ее культивирования.
Следует учесть, что в окружающем мире рост и развитие бактерий сильно ограничены внешними условиями. В процентном соотношении бактерии используют только 1% от своих возможностей. Пересаживая же бактериальную культуру на питательную среду для выращивания, человек должен искусственно создать оптимальные условия для развития именно этой бактерии, что даст ей возможность задействовать весь свой потенциал. В противном случае рост культуры не будет заметен и как такового выращивания не произойдет.
Одной из основных задач микробиологов является определение максимальной питательной смеси для каждого вида бактерий (особенно это важно для тех микроорганизмов, которых задействуют для промышленных производств), чтобы получить их максимальную производительность.

В микробиологии есть ряд требований к питательным средам, на которых допускается возможность культивирования чистых бактериальных колоний:
- среда должна содержать факторы, обеспечивающие рост данной культуры (витамины, аминокислоты);
- допустимый для данной среды фактор рН;
- давление среды не должно быть выше или ниже давления внутри клетки (изотоничность);
- стерильность;
- прозрачность среды, чтобы у исследователя была возможность наблюдать рост и развитие культур.
Принципы культивирования молочнокислых бактерий
К проблеме выращивания молочнокислых бактерий человек имеет определенное отношение с тех давних времен, когда начал употреблять в пищу кисломолочные продукты. Но эти неконтролируемые способы получения в домашних условиях продуктов кисломолочного брожения имеют весьма опосредованное отношение к научно обоснованным способам культивирования представителей рода Лактобацилл.
Цель выращивания штаммов (чистых культур) бактерий рода Лактобацилл – не только промышленное производство молочных продуктов, но и получение наиболее эффективны штаммов пробиотиков и выявление среди бактериальных сообществ молочнокислых бактерий с условно-патогенной и патогенной природой.

Один из самых распространенных способов выращивания молочнокислых представителей рода Лактобациллы – использование в качестве питательной среды для культивирования гидролизатов молочных белков (частично разрушенных пептидов). Именно в таком частично расщепленном виде представители рода Лактобациллы наилучшим образом усваивают необходимые им питательные вещества.
В быту гидролизаты чаще всего можно найти в питательных молочных смесях для вскармливания грудных детей либо в обезжиренном сухом молоке. Чтобы рост колоний молочнокислых бактерий происходил активнее, в питательную среду добавляются протеолитические ферменты (ферменты, способствующие расщеплению связей между аминокислотами в белках).
Благодаря добавлению таких ферментов, для колонии молочнокислых бактерий, которая выращивается, отпадает необходимость самостоятельно продуцировать ферменты, расщепляющие молочные белки. Вся энергия бактерий тратится на рост, размножение и увеличение биомассы, что зачастую является основной целью культивирования молочнокислых бактерий.
Цена одного килограмма питательной среды – около 50 долларов США. Однако само оборудование для выращивания этих микроорганизмов очень недешево.
Культивирование анаэробных представителей рода Энтерококков
Для анаэробных представителей рода Энтерококков необходимо соблюдение специфических требований по выделению и выращиванию этих микробов в лабораторных условиях. Специфика связана с тем, что необходимо контролировать режим доступа света и тепла, которые обеспечивают рост колонии. Хоть микроорганизмы, относящиеся к виду кишечной палочки (Эшерихия Коли), и являются факультативными анаэробами, то есть могут жить в присутствии кислорода, метаболизм этих организмов происходит только в анаэробных условиях, в отсутствие кислорода.

Выращивание этих анаэробных микроорганизмов опасно в домашних условиях.
Питательная среда для выращивания представителей рода Энтеробактерии – кишечной палочки – агар-агар с добавлением:
- сорбита,
- сульфита натрия,
- хлорида натрия.
Такая среда была сконструирована для представителей рода Энтеробактерии – кишечной палочки, после установления ее способности ферментировать (перерабатывать) сорбитол.
Посев с представителями рода Энтеробактерии обязательно нужно держать в темных местах, без доступа света, в термостате при температуре 30°С. К увеличению роста колонии этих анаэробных организмов приводит добавление в питательную среду глюкозы.
Выращивание представителей рода Энтеробактерии – кишечной палочки осуществляется с целью выработки анатоксина кишечной палочки (вещества, препятствующего токсикации организма вследствие отравления продуктами жизнедеятельности кишечной палочки).
Оптимальные питательные среды для микробиологических исследовательских лабораторий находятся в свободной продаже. Цена питательной смеси для выделения и культивирования анаэробных бактерий не слишком высока. Но одной питательной среды мало. Ни одна лаборатория не обойдется без целого ряда специального оборудования, цена на которое очень высокая, и достать его довольно сложно.

Работаю врачом ветеринарной медицины. Увлекаюсь бальными танцами, спортом и йогой. В приоритет ставлю личностное развитие и освоение духовных практик. Любимые темы: ветеринария, биология, строительство, ремонт, путешествия. Табу: юриспруденция, политика, IT-технологии и компьютерные игры.
Условия выращивания (культивирования) микроорганизмов
К важнейшим условиям выращивания микроорганизмов на питательных средах относятся температура, свет, аэрация среды.
4.4.1 Температура. Для оптимального развития микроорганизмов необходима температура, соответствующая видовым потребностям культуры. По отношению к температуре микроорганизмы подразделяются на холодолюбивые (психрофилы), среднетеплолюбивые (мезофилы) и теплолюбивые (термофилы).
Оптимальные температуры развития психрофилов составляет 6-10 о С, но некоторые могут развиваться и при температуре около 0 о С. Температурный оптимум для мезофилов составляет 25 — 30 о С, а термофилов 50-60 о С.
Большинство видов бактерий активно размножаются при температуре 30-37 о С, а мицеллиальные грибы – при 20-22 о С. При отклонении температуры от оптимальной развитие микроорганизмов задерживается. Поэтому для выращивания микроорганизмов используются специальные приборы – термошкафы с термоизоляцией, способные поддерживать постоянную температуру, соответствующую потребностям культур. Такие приборы называются термостатами.
4.4.2 Свет. Большинство микроорганизмов не нуждаются в свете, а прямые солнечные лучи подавляют их развитие. В связи с этим микроорганизмы выращивают в неосвещенных термостатах.
4.4.3 Аэрация. Потребности в свободном кислороде у микроорганизмов неодинаковы. Аэробные и факультативно-анаэробные микроорганизмы выращивают в обычных условиях воздушной среды. Культивирование строгих анаэробов должно производиться в бескислородных условиях, которые создаются различными приемами.
Для культивирования анаэробов применяют:
а) специальные приборы – анаэростаты, из которых выкачивают воздух посредством насоса, а затем помещают в термостат;
б) эксикаторы, из которых воздух либо удаляется, либо заменяется инертным газом (азотом, водородом, диоксидом углерода);
в) аппарат Аристовского – герметически замкнутый сосуд, где происходит связывание кислорода воздуха с помощью химических соединений (щелочного раствора пирогаллола, металлического железа и т.д.);
г) выращивание микроорганизмов в жидкой среде – пробирке 10-15см 3 , залитой слоем стерильного индиффирентного (вазелинового) масла или парафина;
д) розливка среды в узкие пробирки высоким столбиком;
е) совместное выращивание анаэробов и аэробов, обильно поглощающих кислород в герметично залитой парафином чашке Петри.
4.4.4 Сроки культивирования. Большинство культур аэробных бактерий выращивают в течение 24-36ч, анаэробных – 36-72ч, плесневые грибы культивируют в течение недели.
4.4.5 Счет колоний. При небольшом количестве выросших колоний их считают методом прямого счета, с помощью лупы, отмечая сосчитанные колонии восковым карандашом. Для удобства чашки Петри можно разделить на равные сектора, подсчитать количество колоний в одном секторе и, перемножив это количество на число секторов, можно определить общее число колоний, выросших на чашке Петри. Если количество колоний велико и прямой счет их затруднителен, то можно применять специальные счетные камеры – аппарат Вольфюгеля, пластинки Лафара и др.
1) Подготовить пробирки, чашки Петри и пипетки к стерилизации.
2) Приготовить МПА из сухого питательного агара, разлить в пробирки, колбы и простерилизовать в автоклаве.
3) Приготовить агар-«столбик» и агар-«косячок» в пробирках.
4) Разлить МПА в чашки Петри.
5) Произвести посев «штрихом», «уколом» из пробирки в пробирку и посев «газоном» из пробирки в чашку Петри.
6) Оформить протокол исследования, схематически изобразив посев «штрихом», «уколом», «газоном», и представить способы стерилизации в виде следующей таблицы.
Таблица 2 — Способы стерилизации
| Название способа | Где осуще- ствляется | Режимы стерилизации | Для чего применяется | Приме- чание |
К о н т р о л ь н ы е в о п р о с ы:
1) Что представляют собой питательные среды и каким требованиям они должны удовлетворять?
2) Классификация питательных сред.
3) Какие вещества и в каких концентрациях применяются в микробиологической практике для уплотнения питательных сред?
4) Что такое стерилизация и ее основные способы?
5) Что понимаем под термином «дробная» стерилизация и пригодна ли она для стерилизации стеклянной посуды? Обосновать.
6) Что в микробиологической практике называется посевом, пересевом микроорганизмов?
7) Методы посевов (пересевов) микроорганизмов.
 Какие условия нужны для успешного выращивания микроорганизмов?
Какие условия нужны для успешного выращивания микроорганизмов?
9) Способы культивирования анаэробов.
10) Назначение термостата в лаборатории микробиологии.
ЛАБОРАТОРНАЯ РАБОТА №5.
Дата добавления: 2016-11-18 ; просмотров: 1241 | Нарушение авторских прав
Как вам статья?






